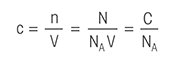Nasledujúce definície titrácie vám môžu uľahčiť naučiť sa všetko, čo potrebujete vedieť o titrácii.
Analyt: Špecifický chemický druh vo vzorke, ktorého obsah alebo množstvo sa určuje titráciou.
Koniec titrácie: Požadovaný koncový bod alebo bod ekvivalencie, pri ktorom sa titrácia ukončí a vyhodnotí sa spotreba titrantu. Počas tej istej titrácie môže nastať viac ako jeden bod ekvivalencie.
Koncový bod: Bod, v ktorom sa pozoruje koniec titračnej reakcie (zvyčajne zmenou farby alebo iným indikátorom titrácie). Definovanie titrácie spolu s jej koncovým bodom predstavuje klasickú techniku.
Bod ekvivalencie: Bod titrácie: Bod, v ktorom je počet jednotiek (ekvivalentov) pridaného titrantu rovnaký ako počet jednotiek analytu vzorky.
Indikácia: Postup na sledovanie reakcie a zistenie konca titrácie. Všeobecne sa indikácia vykonáva pomocou potenciometrie (elektródy) alebo farebných indikátorov.
Paralaxa: Rozdiel v zdanlivej polohe objektu na základe zorného poľa pozorovateľa. Pri titrácii sa tento jav musí brať do úvahy pri vizuálnom pozorovaní kvapalných meniskov v byrete.
Primárny štandard: Certifikovaná, vysoko čistá látka používaná na presné stanovenie koncentrácie titrantu.
Získavanie signálu: Získanie signálu je monitorovanie fyzikálnych javov s cieľom získať digitálne alebo číselné hodnoty v určitých bodoch (ako je koncový bod titračného experimentu alebo bod ekvivalencie).
Štandardizácia: Použitie vysoko čistej referenčnej chemickej látky (štandardu) na stanovenie koncentrácie titrantu.
Stechiometria: Vzťahy mol/hmotnosť medzi činidlami a produktmi pri titrácii. Titračné činidlá reagujú podľa pevne stanovených vzťahov, takže ak je známe množstvo jednotlivých reaktantov, možno vypočítať množstvo produktu. Ak je známe množstvo jedného reaktantu a možno určiť množstvo produktov, možno vypočítať aj množstvo ostatných reaktantov.
Titrant: Roztok určitého chemického činidla, ktorý je štandardizovaný z hľadiska koncentrácie, aby sa mohol použiť na presnú titráciu.
Titrácia: Kvantitatívna chemická analýza, pri ktorej definované množstvo titrantu kvantitatívne reaguje s analyzovanou zlúčeninou vzorky. Z objemu spotrebovaného titrantu sa vypočíta množstvo zlúčeniny vzorky na základe stechiometrie reakcie analýzy. Známa aj ako volumetria alebo titrácia.
Titračná krivka: Titračné krivky znázorňujú kvalitatívny priebeh titrácie. Krivka vo všeobecnosti používa objem titrantu ako nezávislú premennú a roztok ako závislú premennú. Krivka umožňuje rýchle posúdenie titračnej metódy. Krivky majú štyri formy: symetrickú, asymetrickú, minimálnu/maximálnu a segmentovú.
Titračný cyklus: Titračný cyklus: cyklus, ktorý sa vykonáva a opakuje, kým sa nedosiahne koncový bod alebo bod ekvivalencie titračnej reakcie. Titračný cyklus pozostáva predovšetkým zo štyroch krokov: pridanie titrantu, titračná reakcia, získanie signálu a vyhodnotenie.
Titračná rovnica: Séria titračných vzorcov, ktoré umožňujú výpočet hmotnostnej molarity pevných vzoriek, koncentrácie roztokov kyselín a zásad, koncentrácie zriedených roztokov a spotreby titrantu po priamej titrácii. Pre jednoduchý výpočet výsledkov titrácie navštívte našu titračnú kalkulačku.
Teória titrácie: Teória titrácie skúma stanovenie produktu v súvislosti s jeho koncentráciou pozorovaním titračnej reakcie pomocou fyzikálnych alebo elektrochemických metód. Znalosť presnej koncentrácie druhu, produktu alebo chemickej funkcie pomáha zabezpečiť účinnosť procesu a/alebo kvalitu produktu.