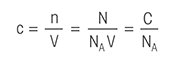Följande titreringsdefinitioner kan göra det lättare för dig att lära dig allt du behöver veta om titrering.
Analyt: Specifik kemisk art i ett prov vars innehåll eller mängd bestäms genom titrering.
Slut på titrering: Den önskade slutpunkten eller ekvivalenspunkten vid vilken titreringen avslutas och titrantförbrukningen utvärderas. Mer än en ekvivalenspunkt kan förekomma under samma titrering.
Slutpunkt: Den punkt vid vilken slutet av titreringsreaktionen observeras (vanligtvis genom färgförändring eller annan titreringsindikator). Att definiera titrering tillsammans med dess slutpunkt representerar den klassiska tekniken.
Ekvivalenspunkt: Den punkt där antalet enheter (ekvivalenter) av det tillsatta titreringsmedlet är detsamma som antalet enheter av provanalyten.
Indikation: Förfarandet för att följa reaktionen och upptäcka slutet på titreringen. Generellt sker indikering med hjälp av potentiometri (elektroder) eller färgindikatorer.
Parallax: Skillnaden i ett objekts skenbara position baserat på observatörens siktlinje. Vid titrering måste detta fenomen beaktas när man visuellt observerar flytande menisker i en burett.
Primär standard: En certifierad, mycket ren substans som används för noggrann bestämning av titrantkoncentrationen.
Signalinsamling: Signalinsamling är övervakning av fysiska fenomen för att erhålla digitala eller numeriska värden vid vissa punkter (t.ex. en slutpunkt eller ekvivalenspunkt för ett titreringsexperiment).
Standardisering: Användning av en mycket ren kemisk referenssubstans (standard) för att bestämma koncentrationen av titreringsmedlet.
Stökiometri: Mol/massförhållandet mellan reagens och produkter vid titrering. Titreringsreagenser reagerar enligt fasta relationer, så om mängden av separata reaktanter är känd kan mängden av produkten beräknas. Om mängden av en reaktant är känd och mängden av produkter kan bestämmas, kan mängden av andra reaktanter också beräknas.
Titrant: En lösning av ett visst kemiskt reagens som är standardiserad i fråga om koncentration så att den kan användas för exakt titrering.
Titrering: En kvantitativ kemisk analys där en definierad mängd titrant reagerar kvantitativt med den provförening som analyseras. Från volymen av förbrukad titrant beräknas mängden provförening baserat på stökiometrin för assayreaktionen. Även känd som volymetri eller titrimetri.
Titreringskurva: Titreringskurvor illustrerar det kvalitativa förloppet av en titrering. I kurvan används i allmänhet titreringsmedlets volym som oberoende variabel och lösningen som beroende variabel. En kurva möjliggör snabb bedömning av titreringsmetoden. Kurvorna har fyra former: symmetrisk, asymmetrisk, minimum/maximum och segmenterad.
Titreringscykel: Den cykel som utförs och upprepas tills slutpunkten eller ekvivalenspunkten för titreringsreaktionen har uppnåtts. Titreringscykeln består huvudsakligen av fyra steg: tillsats av titrant, titreringsreaktion, signalinsamling och utvärdering.
Titreringsekvation: En serie titreringsformler som gör det möjligt att beräkna massmolariteten för fasta prover, koncentrationen av syra- och baslösningar, koncentrationen av utspädda lösningar och titrantförbrukningen efter en direkt titrering. För enkel beräkning av titreringsresultat, besök vår Titration Calculator.
Titreringsteori: Titreringsteori utforskar bestämningen av en produkt relaterad till dess koncentration genom att observera en titreringsreaktion med hjälp av antingen fysiska eller elektrokemiska metoder. Att känna till den exakta koncentrationen av en art, produkt eller kemisk funktion hjälper till att säkerställa processeffektivitet och/eller produktkvalitet.