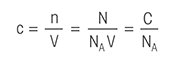Følgende titreringsdefinisjoner kan gjøre det lettere for deg å lære alt du trenger å vite om titrering.
Analytt: Spesifikke kjemiske arter i en prøve hvor innholdet eller mengden bestemmes ved titrering.
Slutt på titrering: Ønsket endepunkt eller ekvivalenspunkt der titreringen avsluttes og titrantforbruket evalueres. Mer enn ett ekvivalenspunkt kan forekomme under samme titrering.
Endepunkt: Punktet der slutten av titreringsreaksjonen observeres (vanligvis ved fargeendring eller en annen titreringsindikator). Å definere titrering sammen med endepunktet representerer den klassiske teknikken.
Ekvivalenspunkt: Punktet hvor antallet enheter (ekvivalenter) av den tilsatte titranten er det samme som antallet enheter av prøveanalytten.
Indikasjon: Prosedyren for å følge reaksjonen og oppdage slutten av titreringen. Vanligvis gjøres indikasjon ved hjelp av potensiometri (elektroder) eller fargeindikatorer.
Parallax: Forskjellen i den tilsynelatende posisjonen til et objekt basert på observatørens siktlinje. Ved titrering må dette fenomenet vurderes når man visuelt observerer flytende menisker i en byrett.
Primærstandard: Et sertifisert, høyrent stoff som brukes for nøyaktig bestemmelse av titrantkonsentrasjon.
Signalinnsamling: Signalinnhenting er overvåking av fysiske fenomener for å oppnå digitale eller numeriske verdier på bestemte punkter (for eksempel et titreringseksperiment-endepunkt eller ekvivalenspunkt).
Standardisering: Bruk av et svært rent kjemisk referansestoff (standard) for å bestemme titrantkonsentrasjon.
Støkiometri: Mol/masse-forholdet mellom reagenser og produkter i titrering. Titreringsreagenser reagerer i henhold til faste forhold, så hvis mengden av separate reaktanter er kjent, kan mengden av produktet beregnes. Hvis mengden av en reaktant er kjent og mengden av produkter kan bestemmes, kan mengden av andre reaktanter også beregnes.
Titrant: En løsning av et bestemt kjemisk reagens som er standardisert når det gjelder konsentrasjon slik at den kan brukes til nøyaktig titrering.
Titrering: En kvantitativ kjemisk analyse der en definert mengde titrant reagerer kvantitativt med prøveforbindelsen som analyseres. Fra volumet av titrant som forbrukes, beregnes mengden prøveforbindelse basert på støkiometrien til analysereaksjonen. Også kjent som volumetri eller titrimetri.
Titreringskurve: Titreringskurver illustrerer den kvalitative fremdriften av en titrering. Kurven bruker vanligvis volumet av titranten som den uavhengige variabelen og løsningen som den avhengige variabelen. En kurve gir rask vurdering av titreringsmetoden. Kurver har fire former: symmetrisk, asymmetrisk, minimum/maksimum og segmentert.
Titreringssyklus: Syklusen som utføres og gjentas til endepunktet eller ekvivalenspunktet for titreringsreaksjonen er nådd. Titreringssyklusen består primært av fire trinn: titranttilsetning, titreringsreaksjon, signalinnsamling og evaluering.
Titreringsligning: En serie titreringsformler som tillater beregning av massemolariteten til faste prøver, konsentrasjonen av syre- og baseløsninger, konsentrasjonen av fortynnede løsninger og titreringsforbruket etter en direkte titrering. For enkel beregning av titreringsresultater, besøk vår titreringskalkulator .
Titreringsteori: Titreringsteori utforsker bestemmelsen av et produkt relatert til dets konsentrasjon ved å observere en titreringsreaksjon ved bruk av enten fysiske eller elektrokjemiske metoder. Å kjenne den nøyaktige konsentrasjonen til en art, et produkt eller en kjemisk funksjon bidrar til å sikre prosesseffektivitet og/eller produktkvalitet.