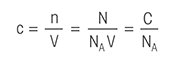Z naslednjimi definicijami titracije boste morda lažje izvedeli vse, kar morate vedeti o titraciji.
Analit: V vzorcu, katerega vsebnost ali količina se določa s titracijo, je določena kemijska vrsta.
Konec titracije: V tem primeru se titracija zaključi in se oceni poraba titranta. Med isto titracijo se lahko pojavi več kot ena ekvivalentna točka.
Končna točka: Točka, na kateri opazimo konec titracijske reakcije (običajno s spremembo barve ali drugim indikatorjem titracije). Opredelitev titracije skupaj z njeno končno točko predstavlja klasično tehniko.
Ekvivalentna točka: Točka titracije: točka, v kateri je število enot (ekvivalentov) dodanega titranta enako številu enot analita v vzorcu.
Indikacija: Postopek za spremljanje reakcije in ugotavljanje konca titracije. Na splošno se indikacija izvaja s potenciometrijo (elektrodami) ali barvnimi indikatorji.
Paralaksa: Razlika v navideznem položaju predmeta glede na opazovalčevo vidno linijo. Pri titraciji je treba ta pojav upoštevati pri vizualnem opazovanju tekoče menzure v bireti.
Primarni standard: Certificirana, zelo čista snov, ki se uporablja za natančno določanje koncentracije titranta.
Pridobivanje signala: Pridobivanje signalov je spremljanje fizikalnih pojavov za pridobitev digitalnih ali numeričnih vrednosti na določenih točkah (kot je končna točka titracijskega poskusa ali ekvivalentna točka).
Standardizacija: Standardizacija: uporaba zelo čiste referenčne kemične snovi (standarda) za določanje koncentracije titranta.
Stehiometrija: Pri titraciji se uporabljajo razmerja mol/masa med reagenti in produkti. Reagenti pri titraciji reagirajo v skladu s fiksnimi razmerji, zato lahko, če je znana količina ločenih reaktantov, izračunamo količino produkta. Če je znana količina enega reaktanta in lahko določimo količino produktov, lahko izračunamo tudi količino drugih reaktantov.
Titrant: Raztopina določenega kemijskega reagenta, ki je standardizirana glede na koncentracijo, tako da jo lahko uporabimo za natančno titracijo.
Titracija: Titracija: kvantitativna kemijska analiza, pri kateri določena količina titranta kvantitativno reagira z vzorčno spojino, ki jo analiziramo. Iz količine porabljenega titranta se izračuna količina vzorčne spojine na podlagi stehiometrije reakcije analize. Znana tudi kot volumetrija ali titrimetrija.
Titracijska krivulja: Titracijske krivulje ponazarjajo kakovostni potek titracije. Krivulja običajno uporablja prostornino titranta kot neodvisno spremenljivko in raztopino kot odvisno spremenljivko. Krivulja omogoča hitro oceno titracijske metode. Krivulje imajo štiri oblike: simetrično, asimetrično, minimalno/ maksimalno in segmentno.
Titracijski cikel: Cikel, ki se izvaja in ponavlja, dokler ni dosežena končna točka ali točka ekvivalence titracijske reakcije. Titracijski cikel je sestavljen predvsem iz štirih korakov: dodajanje titranta, titracijska reakcija, zajem signala in vrednotenje.
Titracijska enačba: Enačba titracije: niz titracijskih formul, ki omogočajo izračun masne molarnosti trdnih vzorcev, koncentracije raztopin kislin in baz, koncentracije razredčenih raztopin in porabe titranta po neposredni titraciji. Za enostaven izračun rezultatov titracije obiščite naš titracijski kalkulator.
Teorija titracije: Teorija titracije raziskuje določanje produkta, povezano z njegovo koncentracijo, z opazovanjem reakcije titracije z uporabo fizikalnih ali elektrokemičnih metod. Poznavanje natančne koncentracije vrste, izdelka ali kemijske funkcije pomaga zagotoviti učinkovitost procesa in/ali kakovost izdelka.