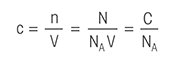Die folgenden Titrationsdefinitionen können es Ihnen erleichtern, alles Wissenswerte über die Titration zu erfahren.
Analyte: Spezifische chemische Spezies in einer Probe, deren Gehalt oder Menge durch Titration bestimmt wird.
Ende der Titration: Der gewünschte Endpunkt oder Äquivalenzpunkt, an dem die Titration beendet und der Titriermittelverbrauch bewertet wird. Während der gleichen Titration kann mehr als ein Äquivalenzpunkt auftreten.
Endpunkt: Der Punkt, an dem das Ende der Titrationsreaktion beobachtet wird (in der Regel durch einen Farbwechsel oder einen anderen Titrationsindikator). Die Definition der Titration zusammen mit ihrem Endpunkt stellt die klassische Technik dar.
Äquivalenzpunkt: Der Punkt, an dem die Anzahl der Einheiten (Äquivalente) des zugegebenen Titriermittels gleich der Anzahl der Einheiten des Probenanalyten ist.
Indikation: Das Verfahren, um die Reaktion zu verfolgen und das Ende der Titration zu erkennen. Im Allgemeinen wird die Indikation mit Hilfe der Potentiometrie (Elektroden) oder Farbindikatoren durchgeführt.
Parallaxe: Der Unterschied in der scheinbaren Position eines Objekts in Abhängigkeit von der Sichtlinie des Beobachters. Bei der Titration muss dieses Phänomen bei der visuellen Beobachtung von flüssigen Menisken in einer Bürette berücksichtigt werden.
Primärstandard: Eine zertifizierte, hochreine Substanz, die für die genaue Bestimmung der Konzentration eines Titranten verwendet wird.
Signalerfassung: Die Signalerfassung ist die Überwachung von physikalischen Phänomenen, um digitale oder numerische Werte an bestimmten Punkten zu erhalten (z.B. Endpunkt eines Titrationsexperiments oder Äquivalenzpunkt).
Standardisierung: Die Verwendung einer hochreinen chemischen Referenzsubstanz (Standard) zur Bestimmung der Titriermittelkonzentration.
Stöchiometrie: Das Mol/Masse-Verhältnis zwischen Reagenzien und Produkten bei der Titration. Titrationsreagenzien reagieren nach festen Beziehungen. Wenn also die Menge der einzelnen Reaktanten bekannt ist, kann die Menge des Produkts berechnet werden. Wenn die Menge eines Reaktanten bekannt ist und die Menge der Produkte bestimmt werden kann, kann auch die Menge der anderen Reaktanten berechnet werden.
Titriermittel: Eine Lösung eines bestimmten chemischen Reagenzes, die in Bezug auf die Konzentration standardisiert ist, damit sie für eine genaue Titration verwendet werden kann.
Titration: Eine quantitative chemische Analyse, bei der eine bestimmte Menge an Titriermittel quantitativ mit der zu analysierenden Probenverbindung reagiert. Aus dem Volumen des verbrauchten Titriermittels wird die Menge der Probenverbindung auf der Grundlage der Stöchiometrie der Testreaktion berechnet. Auch bekannt als Volumetrie oder Titrimetrie.
Titrationskurve: Titrationskurven veranschaulichen den qualitativen Verlauf einer Titration. Die Kurve verwendet im Allgemeinen das Volumen des Titriermittels als unabhängige Variable und die Lösung als abhängige Variable. Eine Kurve ermöglicht eine schnelle Bewertung der Titrationsmethode. Es gibt vier Formen von Kurven: symmetrisch, asymmetrisch, Minimum/Maximum und segmentiert.
Titrationszyklus: Der Zyklus, der durchgeführt und wiederholt wird, bis der Endpunkt oder der Äquivalenzpunkt der Titrationsreaktion erreicht ist. Der Titrationszyklus besteht hauptsächlich aus vier Schritten: Zugabe des Titriermittels, Titrationsreaktion, Signalerfassung und Auswertung.
Titrationsgleichung: Eine Reihe von Titrationsformeln, die die Berechnung der Massenmolarität von festen Proben, der Konzentration von Säure- und Basenlösungen, der Konzentration von verdünnten Lösungen und des Titriermittelverbrauchs nach einer direkten Titration ermöglichen. Zur einfachen Berechnung von Titrationsergebnissen besuchen Sie unseren Titrationsrechner.
Titrationstheorie: Die Titrationstheorie befasst sich mit der Bestimmung eines Produkts in Abhängigkeit von seiner Konzentration durch Beobachtung einer Titrationsreaktion mit Hilfe physikalischer oder elektrochemischer Methoden. Die genaue Kenntnis der Konzentration einer Spezies, eines Produkts oder einer chemischen Funktion hilft dabei, die Prozesseffizienz und/oder die Produktqualität sicherzustellen.