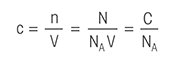Следующая терминология поможет вам облегчить изучение всего, что необходимо знать о титровании.
Аналит ─ специфический вид химического образца, содержание или количество которого определяется титрованием.
Конец титрования ─ желаемая конечная точка или точка эквивалентности, в которой титрование прекращается и оценивается расход титранта. В ходе одного и того же титрования может возникнуть более одной точки эквивалентности.
Конечная точка ─ точка, в которой наблюдается окончание реакции титрования (обычно по изменению цвета или другому индикатору титрования). Титрование по конечной точке представляет собой классическую методику.
Точка эквивалентности ─ точка, в которой количество единиц (эквивалентов) добавленного титранта равно количеству единиц анализируемого образца.
Индикация ─ процедура, позволяющая проследить за ходом реакции и определить окончание титрования. Как правило, индикация осуществляется с помощью потенциометрии (электродов) или цветовых индикаторов.
Параллакс ─ разница в видимом положении объекта в зависимости от линии зрения наблюдателя. В титровании это явление необходимо учитывать при визуальном наблюдении за жидкими менисками в бюретке.
Первичный стандарт ─ сертифицированное, высокочистое вещество, используемое для точного определения концентрации титранта.
Получение сигнала ─ это мониторинг физических явлений для получения цифровых или числовых значений в определенных точках (например, конечная точка титрования или точка эквивалентности).
Стандартизация ─ использование высокочистого эталонного химического вещества (стандарта) для определения концентрации титранта.
Стехиометрия ─ соотношение моль/масса между реагентами и продуктами при титровании. Реагенты для титрования реагируют в соответствии с фиксированными соотношениями, поэтому, если известно количество отдельных реактивов, можно рассчитать количество продукта. Если известно количество одного реактива и можно определить количество продуктов, то можно рассчитать и количество других реактивов.
Титрант ─ раствор определенного химического реагента, который стандартизирован по концентрации, чтобы его можно было использовать для точного титрования.
Титрование ─ количественный химический анализ, при котором определенное количество титранта вступает в реакцию с анализируемым соединением образца. По объему израсходованного титранта рассчитывается количество анализируемого соединения на основе стехиометрии реакции. Также известен как волюметрия или титриметрия.
Кривая титрования ─ график, иллюстрирующий качественный ход титрования. Кривая обычно использует объем титранта в качестве независимой переменной, а раствор - в качестве зависимой переменной. Кривая позволяет быстро оценить метод титрования. Кривые имеют четыре формы: симметричная, асимметричная, минимум/максимум и сегментированная.
Цикл титрования ─ цикл, который выполняется и повторяется до достижения конечной точки или точки эквивалентности реакции титрования. Цикл титрования состоит в основном из четырех этапов: добавление титранта, реакция титрования, получение сигнала и оценка.
Уравнение титрования ─ серия формул титрования, которые позволяют рассчитать молярную массу твердых образцов, концентрацию растворов кислоты и основания, концентрацию разбавленных растворов и расход титранта после прямого титрования. Для простого расчета результатов используйте калькулятор титрования.
Теория титрования изучает определение продукта в зависимости от его концентрации путем наблюдения за реакцией титрования с использованием физических или электрохимических методов. Знание точной концентрации вида, продукта или химической функции помогает обеспечить эффективность процесса и/или качество продукции.