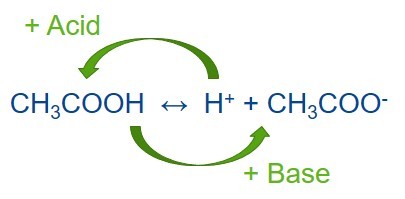
Nei laboratori chimici e biochimici, la preparazione dei buffer è una procedura comune. Una soluzione buffer è una miscela formata da un acido debole e dalla sua base coniugata oppure da una base debole e dal suo acido coniugato. Le soluzioni buffer vengono usate per contribuire a mantenere la stabilità del valore di pH di un'altra soluzione, a sua volta miscelata con il buffer. Il buffer resiste alle variazioni del valore di pH dell'intera soluzione quando in quest'ultima viene introdotta una piccola quantità di acido o alcali diverso, sia tramite aggiunta che per reazione chimica. Le soluzioni buffer sono quindi molto utili per un'ampia gamma di applicazioni in cui è richiesto un pH relativamente stabile. Un buffer può anche essere chiamato pH tampone, ione idrogeno buffer o soluzione buffer.
Il sangue, ad esempio, contiene buffer naturali per mantenere un pH stabile compreso tra 7.35 e 7.45, in modo che i nostri enzimi funzionino correttamente. Dato che l'attività enzimatica varia con il pH, è essenziale che nelle analisi biochimiche questo valore sia costante per garantire l'osservazione del livello di attività corretto. A livello commerciale, i buffer si trovano negli shampoo per prevenire l'irritazione della pelle, nelle lozioni per bambini per inibire la proliferazione di batteri e nelle soluzioni delle lenti a contatto per garantire che il livello di pH del fluido rimanga compatibile con quello dell'occhio.
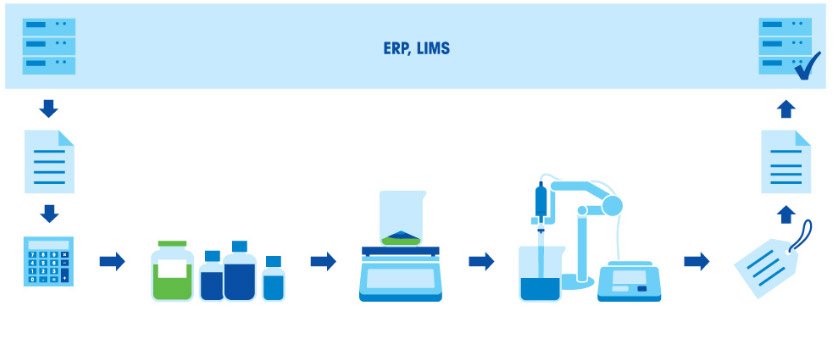
La preparazione dei buffer prevede diversi passaggi: pesare e sciogliere i componenti, regolare il pH e portare la soluzione al volume finale. Dato che il rapporto tra acido e base in un buffer è direttamente correlato al pH finale, è fondamentale pesare i componenti con un elevato livello di accuratezza. Per questo, è importante che gli strumenti usati (bilancia, pipette e pHmetro) vengano correttamente tarati e siano sufficientemente accurati.