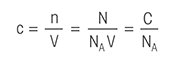Sljedeće definicije titracije mogu vam olakšati da naučite sve što trebate znati o titraciji.
Analit: Specifične kemijske vrste u uzorku čiji se sadržaj ili količina određuju titracijom.
Završetak titracije: željena krajnja točka ili točka ekvivalencije na kojoj se titracija prekida i procjenjuje potrošnja titranta. Tijekom iste titracije može se pojaviti više od jedne točke ekvivalencije.
Krajnja točka: Točka u kojoj se opaža kraj reakcije titracije (obično promjenom boje ili drugim indikatorom titracije). Definiranje titracije zajedno s krajnjom točkom predstavlja klasičnu tehniku.
Točka ekvivalencije: Točka u kojoj je broj entiteta (ekvivalenata) dodanog titranta isti kao broj entiteta analita u uzorku.
Indikacija: Postupak za praćenje reakcije i otkrivanje kraja titracije. Općenito, indikacija se vrši pomoću potenciometrije (elektrode) ili indikatora u boji.
Paralaksa: Razlika u prividnom položaju objekta na temelju linije promatrača. Kod titracije, ovaj se fenomen mora uzeti u obzir pri vizualnom promatranju tekućih meniskusa u bireti.
Primarni standard: certificirana, vrlo čista tvar koja se koristi za točno određivanje koncentracije titranta.
Akvizicija signala: Akvizicija signala je praćenje fizičkih pojava radi dobivanja digitalnih ili numeričkih vrijednosti na određenim točkama (kao što je krajnja točka titracijskog eksperimenta ili točka ekvivalencije).
Standardizacija: Upotreba vrlo čiste referentne kemijske tvari (standard) za određivanje koncentracije titranta.
Stehiometrija: Odnosi mol/masa između reagensa i proizvoda u titraciji. Titracijski reagensi reagiraju prema fiksnim odnosima, pa ako je poznata količina zasebnih reaktanata, može se izračunati količina produkta. Ako je poznata količina jednog reaktanta i može se odrediti količina produkata, može se izračunati i količina ostalih reaktanata.
Titrant: Otopina određenog kemijskog reagensa koja je standardizirana u smislu koncentracije tako da se može koristiti za preciznu titraciju.
Titracija: Kvantitativna kemijska analiza u kojoj definirana količina titranta kvantitativno reagira sa spojem uzorka koji se analizira. Iz volumena potrošenog titranta izračunava se količina uzorka spoja na temelju stehiometrije reakcije ispitivanja. Također poznat kao volumetrija ili titrimetrija.
Titracijska krivulja: Titracijske krivulje ilustriraju kvalitativni napredak titracije. Krivulja općenito koristi volumen titranta kao nezavisnu varijablu i otopinu kao zavisnu varijablu. Krivulja omogućuje brzu procjenu metode titracije. Krivulje imaju četiri oblika: simetrične, asimetrične, minimalne/maksimalne i segmentirane.
Ciklus titracije: ciklus koji se izvodi i ponavlja dok se ne postigne krajnja točka ili točka ekvivalencije reakcije titracije. Ciklus titracije prvenstveno se sastoji od četiri koraka: dodavanje titranta, reakcija titracije, prikupljanje signala i procjena.
Jednadžba titracije: Niz titracijskih formula koje omogućuju izračun molarnosti mase krutih uzoraka, koncentracije kiselih i baznih otopina, koncentracije razrijeđenih otopina i potrošnje titranta nakon izravne titracije. Za jednostavan izračun rezultata titracije, posjetite naš Kalkulator titracije .
Teorija titracije: Teorija titracije istražuje određivanje produkta povezanog s njegovom koncentracijom promatranjem reakcije titracije pomoću fizikalnih ili elektrokemijskih metoda. Poznavanje točne koncentracije vrste, proizvoda ili kemijske funkcije pomaže u osiguravanju učinkovitosti procesa i/ili kvalitete proizvoda.