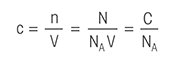Následující definice titrace vám mohou usnadnit získání všech potřebných informací o titraci.
Analyt: Analyt: Specifický chemický druh ve vzorku, jehož obsah nebo množství se určuje titrací.
Konec titrace: Požadovaný koncový bod nebo bod ekvivalence, při kterém je titrace ukončena a vyhodnocena spotřeba titrantu. Během jedné titrace může nastat více než jeden bod ekvivalence.
Koncový bod: Bod, ve kterém se pozoruje konec titrační reakce (obvykle podle změny barvy nebo jiného titračního indikátoru). Definice titrace spolu s jejím koncovým bodem představuje klasickou techniku.
Bod ekvivalence: Bod titrace: Bod, ve kterém je počet jednotek (ekvivalentů) přidaného titrantu stejný jako počet jednotek analytu vzorku.
Indikace: Postup, kterým se sleduje reakce a zjišťuje konec titrace. Obecně se indikace provádí pomocí potenciometrie (elektrody) nebo barevných indikátorů.
Paralaxa: Rozdíl ve zdánlivé poloze objektu na základě zorného pole pozorovatele. Při titraci je třeba tento jev zohlednit při vizuálním pozorování kapalných menisků v byretě.
Primární standard: Certifikovaná, vysoce čistá látka používaná k přesnému stanovení koncentrace titrantu.
Získávání signálu: Získávání signálu je sledování fyzikálních jevů za účelem získání digitálních nebo číselných hodnot v určitých bodech (například v koncovém bodě titračního experimentu nebo v bodě ekvivalence).
Standardizace: Použití vysoce čisté referenční chemické látky (standardu) ke stanovení koncentrace titrantu.
Stechiometrie: Při titraci se jedná o vztahy mol/hmotnost mezi činidly a produkty. Titrační činidla reagují podle pevně stanovených vztahů, takže pokud je známo množství jednotlivých reaktantů, lze vypočítat množství produktu. Pokud je známo množství jednoho reaktantu a lze určit množství produktů, lze vypočítat i množství ostatních reaktantů.
Titrant: Roztok určitého chemického činidla, který je standardizován z hlediska koncentrace, aby mohl být použit k přesné titraci.
Titrace: Titrace: kvantitativní chemická analýza, při níž definované množství titrantu kvantitativně reaguje s analyzovanou sloučeninou vzorku. Z objemu spotřebovaného titrantu se vypočítá množství sloučeniny vzorku na základě stechiometrie analytické reakce. Známá také jako volumetrie nebo titrace.
Titrační křivka: Titrační křivky znázorňují kvalitativní průběh titrace. Křivka obvykle používá objem titrantu jako nezávislou proměnnou a roztok jako závislou proměnnou. Křivka umožňuje rychlé vyhodnocení titrační metody. Křivky mají čtyři podoby: symetrickou, asymetrickou, minimální/maximální a segmentovou.
Titrační cyklus: Titrační cyklus: cyklus, který se provádí a opakuje, dokud není dosaženo koncového bodu nebo bodu ekvivalence titrační reakce. Titrační cyklus se skládá především ze čtyř kroků: přidání titrantu, titrační reakce, získání signálu a vyhodnocení.
Titrační rovnice: Titrační rovnice: Řada titračních vzorců, které umožňují výpočet hmotnostní molarity pevných vzorků, koncentrace roztoků kyselin a zásad, koncentrace zředěných roztoků a spotřeby titrantu po přímé titraci. Pro snadný výpočet výsledků titrace navštivte naši titrační kalkulačku.
Teorie titrace: Teorie titrace zkoumá stanovení produktu v závislosti na jeho koncentraci pozorováním titrační reakce pomocí fyzikálních nebo elektrochemických metod. Znalost přesné koncentrace druhu, produktu nebo chemické funkce pomáhá zajistit účinnost procesu a/nebo kvalitu produktu.